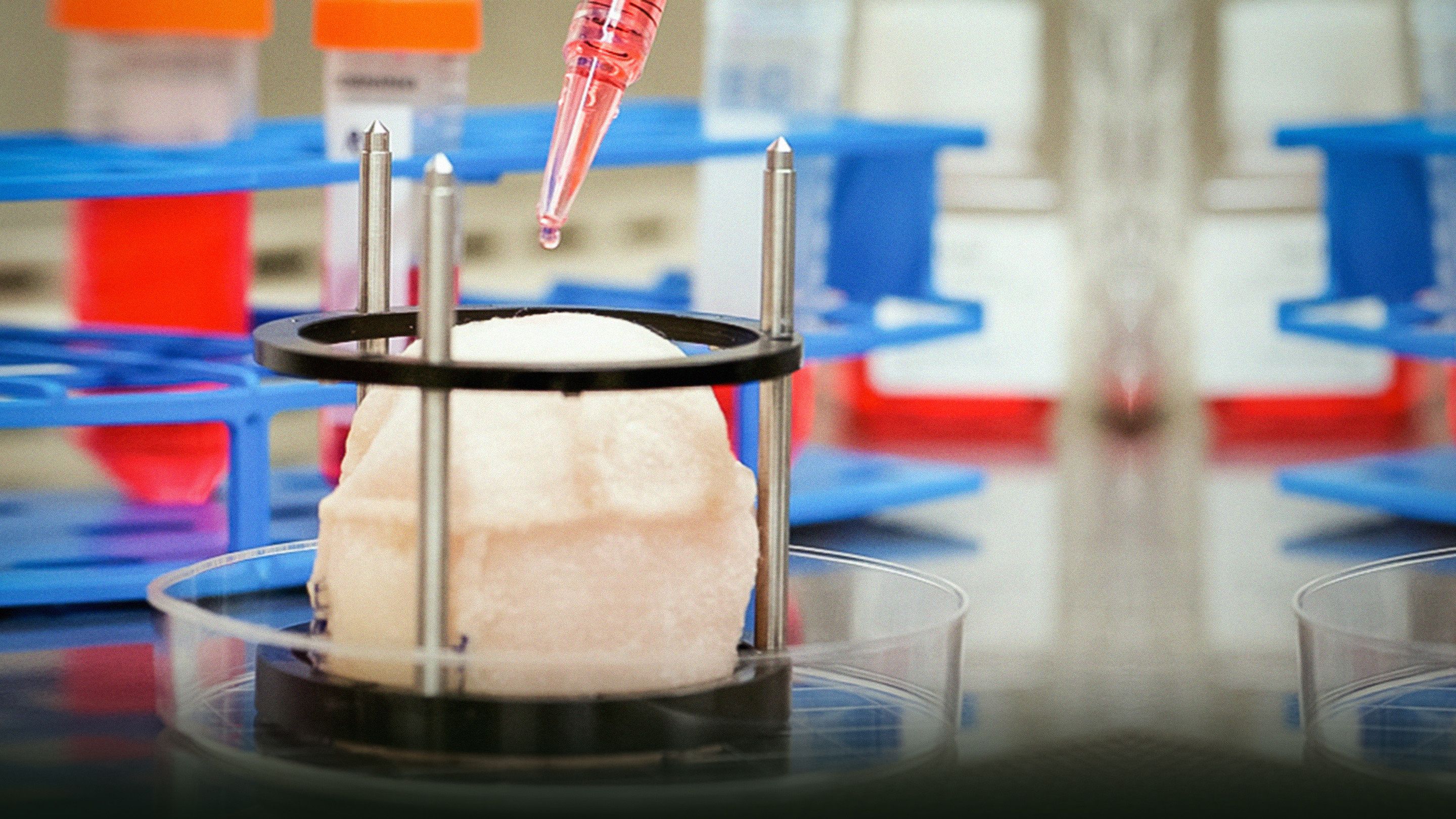
Anthony Atala over het kweken van nieuwe organen
2,018,702 views |
Anthony Atala |
TEDMED 2009
• October 2009
Anthony Atala's moderne laboratorium kweekt menselijke organen -- van spieren tot aders tot blazen, en meer. Bij TEDMED laat hij beelden zien van zijn bio-ingenieurs die werken met science-fiction apparaten uit het lab, waaronder een oven-achtige bioreactor (voorverwarmen op 37 graden) en een machine die menselijk weefsel kan 'printen'.