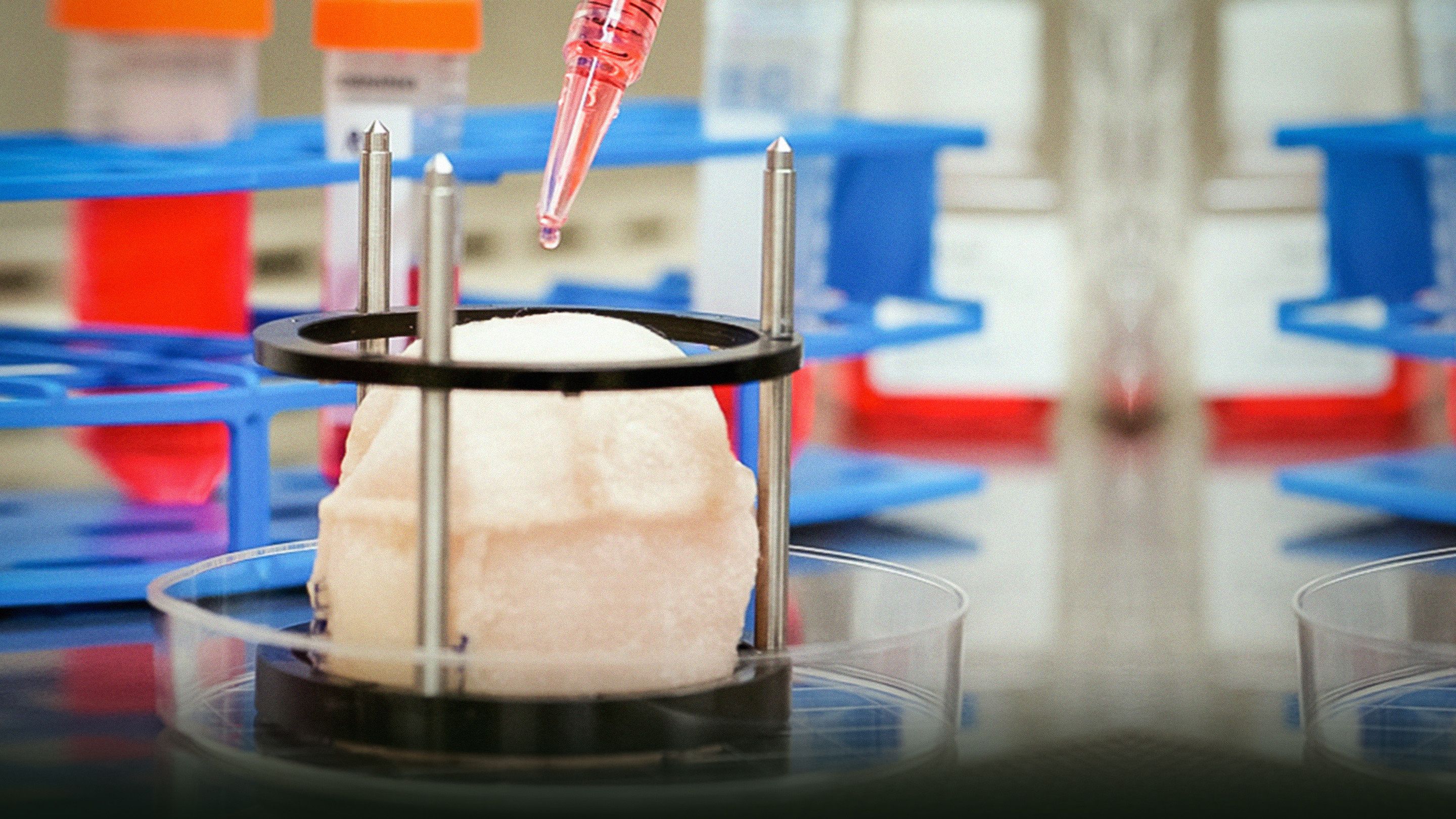
Anthony Atala om at dyrke nye organer
2,018,129 views |
Anthony Atala |
TEDMED 2009
• October 2009
Anthony Atala's state-of-the-art laboratorium dyrker menneskelige organer -- fra muskler, til blodkar, til blære og mere. Ved TEDMED viser han optagelser af hans bio-ingeniører der arbejder med nogle af dens sci-fi dimser, inklusive en oven lignende bioreactor (forvarm til 37 grader C) og en maskine der "printer" menneskeligt væv.